Die Bildung von Ionen ist ein grundlegender Prozess in der Chemie, der durch die Abgabe oder Aufnahme von Elektronen von Atomen erfolgt. Ein Ion entsteht, wenn ein Atom ein Elektron abgibt oder aufnimmt, was zu einer Ungleichheit der positiven und negativen Ladungen im Atom führt. Diese Veränderungen sind entscheidend für viele chemische Reaktionen und die Bildung von Verbindungen.
In diesem Artikel werden wir die Überraschungen der Ionbildung erkunden und verstehen, wie Elektronentransfer funktioniert. Wir werden die Unterschiede zwischen positiven und negativen Ionen betrachten und die Rolle von Elektronen in diesem Prozess analysieren. Außerdem werden wir Beispiele für häufige Ionen und deren Anwendungen in der täglichen Chemie diskutieren.
Wichtige Informationen:- Ein Ion entsteht durch die Abgabe oder Aufnahme von Elektronen, was die Ladung des Atoms verändert.
- Positive Ionen (Kationen) entstehen durch Elektronenabgabe, während negative Ionen (Anionen) durch Elektronenaufnahme entstehen.
- Die Elektronenkonfiguration eines Atoms beeinflusst seine Fähigkeit, Ionen zu bilden.
- Ionisierungsenergie ist entscheidend für die Bildung von Ionen, da sie angibt, wie viel Energie benötigt wird, um ein Elektron zu entfernen.
- Häufige Ionen wie Na+ und Cl- haben spezifische chemische Eigenschaften und Anwendungen in der Industrie und im Alltag.
- Ionische Bindungen sind wichtig für die Stabilität von Molekülen und spielen eine zentrale Rolle in biologischen Systemen.
Die Grundlagen der Ionbildung: Was sind Ionen und wie entstehen sie?
Ionen sind elektrisch geladene Teilchen, die durch die Abgabe oder Aufnahme von Elektronen von Atomen entstehen. Diese Veränderung der Elektronenzahl führt zu einer Ungleichheit zwischen positiven und negativen Ladungen, was das Atom in ein Ion verwandelt. Ionen spielen eine entscheidende Rolle in vielen chemischen Reaktionen und sind die Bausteine für zahlreiche Verbindungen, die sowohl in der Natur als auch in der Industrie vorkommen.
Die Bildung von Ionen erfolgt in einem Prozess, der als Elektronentransfer bekannt ist. Dabei gibt ein Atom ein Elektron ab oder nimmt eines auf, um eine stabilere Elektronenkonfiguration zu erreichen. Dieser Prozess ist häufig mit der Bildung von chemischen Bindungen verbunden, die die Grundlage für die Stabilität von Molekülen bilden. In den folgenden Abschnitten werden wir tiefer in die Mechanismen eintauchen, die zur Ionbildung führen.
Der Prozess der Elektronentransfer: Wie Ionen gebildet werden
Der Elektronentransfer ist der Schlüssel zur Ionbildung. In diesem Prozess gibt ein Atom, das weniger Elektronen hat, diese ab, um ein Kation zu bilden, während ein Atom, das mehr Elektronen benötigt, ein Elektron aufnimmt und ein Anion bildet. Dieser Transfer geschieht oft in Reaktionen zwischen Metallen und Nichtmetallen. Die Bedingungen, unter denen dieser Prozess stattfindet, können variieren, aber sie sind häufig durch Temperatur und Druck beeinflusst.
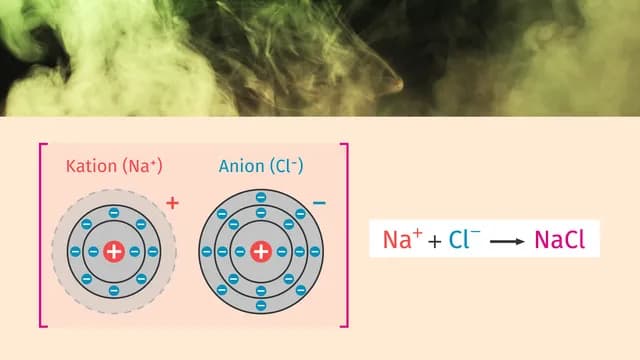
Ein klassisches Beispiel für den Elektronentransfer ist die Reaktion zwischen Natrium (Na) und Chlor (Cl). In dieser Reaktion gibt Natrium ein Elektron ab und wird zu einem Natriumion (Na+), während Chlor ein Elektron aufnimmt und zu einem Chloridion (Cl-) wird. Solche Reaktionen sind grundlegend für die Bildung von ionischen Verbindungen, die in vielen alltäglichen Anwendungen vorkommen.
Unterschiede zwischen positiven und negativen Ionen: Ein Überblick
Bei der Bildung von Ionen gibt es zwei Hauptkategorien: Kationen und Anionen. Kationen sind positiv geladene Ionen, die entstehen, wenn ein Atom ein oder mehrere Elektronen abgibt. Dies führt zu einem Überschuss an positiven Ladungen, da die Anzahl der Protonen im Atom größer ist als die Anzahl der Elektronen. Im Gegensatz dazu sind Anionen negativ geladene Ionen, die entstehen, wenn ein Atom ein oder mehrere Elektronen aufnimmt. Hierbei überwiegt die negative Ladung, da die Anzahl der Elektronen die der Protonen übersteigt.
Die Bildung von Kationen und Anionen erfolgt durch unterschiedliche chemische Prozesse. Kationen entstehen häufig in Reaktionen, in denen Metalle Elektronen abgeben, während Anionen typischerweise bei Reaktionen zwischen Nichtmetallen und Metallen entstehen, wenn Nichtmetalle Elektronen aufnehmen. Diese Unterschiede sind entscheidend für die Eigenschaften und das Verhalten der Ionen in chemischen Reaktionen.
Die Rolle von Elektronen in der Ionbildung: Bedeutung verstehen
Die Elektronenkonfiguration eines Atoms spielt eine wesentliche Rolle bei der Ionbildung. Jedes Atom hat eine spezifische Anordnung seiner Elektronen in verschiedenen Energieniveaus oder Schalen. Diese Anordnung beeinflusst, wie leicht ein Atom Elektronen abgeben oder aufnehmen kann. Atome streben danach, eine stabile Elektronenkonfiguration zu erreichen, die häufig der von Edelgasen entspricht. Aus diesem Grund neigen Atome mit wenigen Elektronen in ihrer äußersten Schale dazu, Elektronen abzugeben und Kationen zu bilden, während Atome mit fast voll besetzten Schalen Elektronen aufnehmen, um Anionen zu bilden.
Ein weiteres wichtiges Konzept in der Ionbildung ist die Ionisierungsenergie. Diese Energie ist notwendig, um ein Elektron von einem Atom zu entfernen. Je höher die Ionisierungsenergie, desto schwieriger ist es für ein Atom, ein Elektron abzugeben und ein Kation zu bilden. Atome mit niedriger Ionisierungsenergie neigen dazu, leichter Ionen zu bilden. Daher ist die Ionisierungsenergie ein entscheidender Faktor, der die Fähigkeit eines Atoms beeinflusst, Ionen zu bilden und somit die chemischen Eigenschaften der Elemente bestimmt.
Elektronenkonfiguration: Wie beeinflusst sie die Ionbildung?
Die Elektronenkonfiguration eines Atoms beschreibt die Anordnung seiner Elektronen in verschiedenen Energieniveaus oder Schalen. Diese Anordnung hat einen direkten Einfluss darauf, wie leicht ein Atom Elektronen abgeben oder aufnehmen kann, was für die Bildung von Ionen entscheidend ist. Atome streben danach, eine stabile Elektronenkonfiguration zu erreichen, die oft der von Edelgasen ähnelt. Elemente mit wenigen Elektronen in ihrer äußersten Schale neigen dazu, Elektronen abzugeben und Kationen zu bilden, während Elemente mit fast voll besetzten Schalen dazu tendieren, Elektronen aufzunehmen und Anionen zu bilden.
Ein Beispiel für diese Dynamik ist das Element Natrium (Na). Es hat eine Elektronenkonfiguration von 1s² 2s² 2p⁶ 3s¹, was bedeutet, dass es ein Elektron in seiner äußersten Schale hat. Dieses Elektron gibt es leicht ab, um ein Kation (Na+) zu bilden. Im Gegensatz dazu hat Chlor (Cl) eine Elektronenkonfiguration von 1s² 2s² 2p⁶ 3s² 3p⁵. Es benötigt nur ein Elektron, um eine stabile Konfiguration zu erreichen, und nimmt dieses auf, um ein Anion (Cl-) zu bilden. Solche Unterschiede in der Elektronenkonfiguration sind entscheidend für die Ionenbildung und das chemische Verhalten der Elemente.
Ionisierungsenergie: Warum ist sie entscheidend für die Bildung?
Die Ionisierungsenergie ist die Energie, die benötigt wird, um ein Elektron von einem Atom zu entfernen. Sie spielt eine entscheidende Rolle in der Ionbildung, da sie bestimmt, wie leicht ein Atom ein Elektron abgeben kann. Atome mit niedriger Ionisierungsenergie neigen dazu, leichter Kationen zu bilden, während Atome mit hoher Ionisierungsenergie eher dazu neigen, ihre Elektronen zu behalten. Diese Energie variiert je nach Atomtyp und ist ein wichtiger Faktor, der die chemischen Eigenschaften und das Reaktionsverhalten von Elementen beeinflusst.
Ein Beispiel ist das Element Lithium (Li), das eine relativ niedrige Ionisierungsenergie hat, was bedeutet, dass es leicht ein Elektron abgeben kann, um ein Kation (Li+) zu bilden. Im Gegensatz dazu hat Neon (Ne) eine hohe Ionisierungsenergie, was es stabil macht und es ihm ermöglicht, keine Ionen zu bilden. Die Ionisierungsenergie ist somit entscheidend für das Verständnis der Bildung von Ionen und ihrer Rolle in chemischen Reaktionen.
Mehr lesen: Bildung LSA: Wichtige Informationen und Ressourcen für Lehrer und Schulen
Beispiele für häufige Ionen: Verstehen ihrer Eigenschaften und Anwendungen

Bei der Bildung von Ionen gibt es zahlreiche Beispiele, die häufig in der Chemie vorkommen. Zu den bekanntesten Kationen gehört das Natriumion (Na+), das entsteht, wenn Natrium ein Elektron abgibt. Dieses Ion ist entscheidend für viele biochemische Prozesse im Körper, einschließlich der Regulation des Wasserhaushalts. Ein weiteres häufiges Kation ist das Kalziumion (Ca2+), das eine wichtige Rolle in der Muskelkontraktion und der Blutgerinnung spielt.
Auf der Anionenseite ist das Chloridion (Cl-) ein bekanntes Beispiel. Es entsteht, wenn Chlor ein Elektron aufnimmt und ist ein wesentlicher Bestandteil von Kochsalz (NaCl). Chloridionen sind wichtig für die Aufrechterhaltung des osmotischen Drucks in Zellen. Diese Ionen finden sich nicht nur in der Natur, sondern auch in vielen industriellen Anwendungen, wie z.B. in der Wasseraufbereitung und der Lebensmittelkonservierung.
| Ion | Ladung | Eigenschaften | Anwendungen |
|---|---|---|---|
| Natriumion (Na+) | +1 | Wichtig für die Nervenfunktion und den Wasserhaushalt | Lebensmittel, Elektrolytlösungen |
| Kalziumion (Ca2+) | +2 | Wesentlich für Muskelkontraktionen und Knochenstärke | Ergänzungsmittel, Bau von Zähnen und Knochen |
| Chloridion (Cl-) | -1 | Reguliert den osmotischen Druck in Zellen | Kochsalz, Wasseraufbereitung |
Kationen und Anionen: Beispiele und ihre chemischen Eigenschaften
Kationen und Anionen zeigen unterschiedliche chemische Eigenschaften, die ihre Reaktivität und Stabilität beeinflussen. Zum Beispiel ist das Natriumion (Na+) ein sehr reaktives Kation, das leicht mit anderen Ionen reagiert, um stabile Verbindungen zu bilden. Es hat eine starke Affinität zu Chloridionen (Cl-), was zur Bildung von Kochsalz führt. Auf der anderen Seite ist das Chloridion ein stabiles Anion, das in der Lage ist, mit verschiedenen Kationen zu interagieren und dabei ionische Bindungen zu bilden.
Ein weiteres Beispiel ist das Kalziumion (Ca2+), das in biologischen Systemen eine zentrale Rolle spielt. Es bildet stabile Verbindungen mit Phosphat-Ionen (PO₄3-), die für die Bildung von Knochen und Zähnen notwendig sind. Diese chemischen Eigenschaften machen Kationen und Anionen unverzichtbar für viele chemische Reaktionen und biologische Prozesse.
Bedeutung von Ionen in chemischen Reaktionen: Anwendungen im Alltag
Ionen spielen eine entscheidende Rolle in vielen chemischen Reaktionen und sind für zahlreiche alltägliche Anwendungen unerlässlich. Zum Beispiel sind sie an der Bildung von Salzlösungen beteiligt, die in der Lebensmittelindustrie zur Konservierung und Aromatisierung verwendet werden. Wenn Kochsalz (NaCl) in Wasser gelöst wird, dissociiert es in Natrium- (Na+) und Chloridionen (Cl-), die für den Geschmack und die Stabilität von Lebensmitteln wichtig sind.
Ein weiteres Beispiel ist die Verwendung von Ionen in Batterien. Lithium-Ionen-Batterien, die in vielen modernen Geräten wie Smartphones und Laptops verwendet werden, basieren auf der Bewegung von Lithium-Ionen zwischen der Anode und der Kathode. Diese Ionenbewegung ermöglicht die Speicherung und Freisetzung von Energie. Auch in der Wasseraufbereitung sind Ionen wichtig, da sie helfen, Verunreinigungen zu entfernen und die Wasserqualität zu verbessern.
Die Auswirkungen der Ionbildung: Chemische Reaktionen und mehr
Die Ionbildung hat weitreichende Auswirkungen auf chemische Reaktionen und die Bildung ionischer Bindungen. Ionische Bindungen entstehen, wenn Kationen und Anionen durch elektrostatische Anziehungskräfte zusammengehalten werden. Diese Art von Bindung ist besonders stark und führt zur Bildung stabiler Verbindungen, die in der Natur häufig vorkommen, wie z.B. in Salzen. Die Stabilität dieser Verbindungen ist entscheidend für viele chemische Prozesse, einschließlich der Bildung von Mineralien und der Struktur von biologischen Molekülen.
Darüber hinaus spielen Ionen eine zentrale Rolle in biologischen Systemen. Sie sind entscheidend für die Aufrechterhaltung des elektrochemischen Gleichgewichts in Zellen, was für die Nervenübertragung und die Muskelfunktion unerlässlich ist. Kalium- (K+) und Natriumionen (Na+) sind beispielsweise entscheidend für die Erzeugung von Aktionspotentialen in Nervenzellen. Diese Prozesse sind grundlegend für die Kommunikation zwischen Zellen und die Funktion des gesamten Organismus.
Ionische Bindungen: Wie Ionen Moleküle bilden und stabilisieren
Ionische Bindungen entstehen, wenn Kationen und Anionen durch ihre entgegengesetzten elektrischen Ladungen angezogen werden. Diese Bindungen sind stark und führen zur Bildung stabiler Verbindungen, die in der Natur häufig vorkommen. Ein typisches Beispiel ist die Bildung von Natriumchlorid (NaCl), wo Natriumionen (Na+) und Chloridionen (Cl-) sich zu einem stabilen Salz verbinden. Diese stabilen Verbindungen sind nicht nur in der Chemie wichtig, sondern auch in der Biologie, da sie viele der strukturellen und funktionellen Eigenschaften von Zellen und Geweben bestimmen.
Die Rolle von Ionen in biologischen Systemen: Einblicke in die Biochemie
Ionen sind in biologischen Systemen von entscheidender Bedeutung, da sie viele grundlegende Prozesse unterstützen. Zum Beispiel sind Calciumionen (Ca2+) wichtig für die Signalübertragung in Zellen und die Muskelkontraktion. Ebenso spielen Magnesiumionen (Mg2+) eine zentrale Rolle in enzymatischen Reaktionen und der Energieproduktion in Zellen. Die richtige Konzentration von Ionen ist entscheidend für die Aufrechterhaltung der Zellfunktionen und die Gesundheit des gesamten Organismus.Innovationen in der Ionenanwendung: Zukünftige Trends und Technologien
Die Fortschritte in der Ionenforschung eröffnen spannende Möglichkeiten in verschiedenen Bereichen, einschließlich der Medizin, der Umwelttechnik und der Energieerzeugung. Eine vielversprechende Anwendung ist die Entwicklung von ionischen Flüssigkeiten, die als umweltfreundliche Lösungsmittel in chemischen Reaktionen eingesetzt werden können. Diese Flüssigkeiten haben das Potenzial, die Effizienz von Reaktionen zu steigern und gleichzeitig die Umweltbelastung durch herkömmliche Lösungsmittel zu reduzieren. Ihre einzigartige Fähigkeit, Ionen zu stabilisieren, macht sie zu einem idealen Kandidaten für die Entwicklung neuer Materialien und Katalysatoren.
Ein weiterer spannender Trend ist die Verwendung von ionischen Sensoren in der Biotechnologie. Diese Sensoren können spezifische Ionen in biologischen Proben nachweisen und bieten somit neue Ansätze zur Überwachung von Gesundheitszuständen oder zur Diagnose von Krankheiten. Die Integration solcher Technologien in tragbare Geräte könnte die persönliche Gesundheitsüberwachung revolutionieren und den Zugang zu schnellen, präzisen Diagnosen verbessern. Die Zukunft der Ionenanwendung ist vielversprechend und könnte entscheidend zur Lösung globaler Herausforderungen beitragen.